|
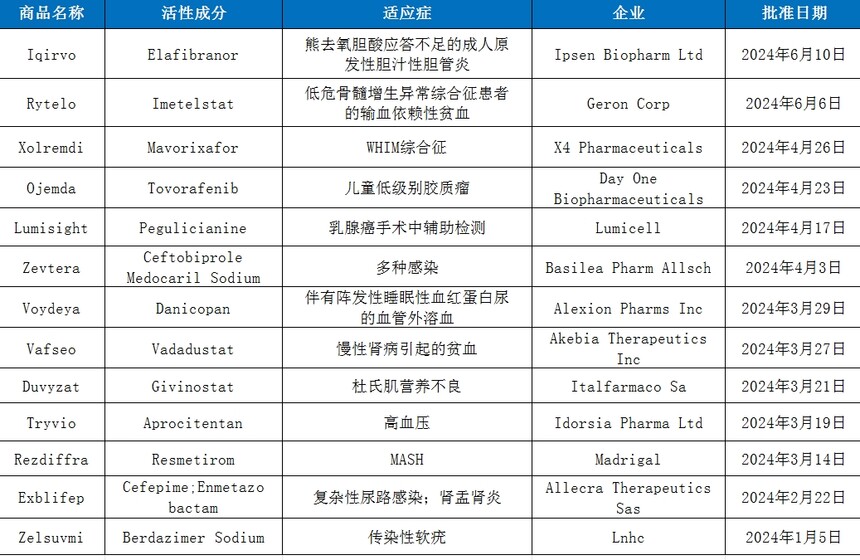
2024上半年FDA批準的新(xīn)藥時間:2024-10-18 上半年,FDA批準多(duō)款具(jù)有(yǒu)裏程碑意義藥物(wù),看點頗多(duō): 40年來首款非酒精(jīng)性脂肪性肝炎藥物(wù)Rezdiffra獲批上市;時隔32年,又(yòu)一款應用(yòng)于腫瘤免疫治療的細胞因子藥物(wù)Anktiva獲批上市等等。 截至目前,2024年上半年CDER批準了18個新(xīn)分(fēn)子實體(tǐ),其中(zhōng)包括13款化藥新(xīn)藥和5款生物(wù)藥新(xīn)藥。值得一提的是,今年上半年的新(xīn)藥獲批數量明顯少于去年,2023年同期已有(yǒu)20多(duō)款新(xīn)分(fēn)子實體(tǐ)獲批,主要是化藥新(xīn)藥上市數量減少(去年同期有(yǒu)17款化藥新(xīn)藥上市)。
數據來源:FDA、藥智數據 從審批方式看,獲批的13款新(xīn)化藥中(zhōng)Iqirvo、Xolremdi、Ojemda等8款藥物(wù)是通過優先審評上市,與NDA标準審批需要10個月相比,優先審評需在6個月内完成,節省了企業的時間成本,同時優先審評的藥物(wù)具(jù)有(yǒu)更高的治療價值。 從适應症上來看,代謝(xiè)類疾病治療領域有(yǒu)4款,腫瘤領域有(yǒu)3款,免疫治療領域有(yǒu)2款,抗感染領域有(yǒu)2款,神經系統和其他(tā)領域各1款。在獲批的化藥新(xīn)藥中(zhōng)孤兒藥有(yǒu)6款,占比接近一半,可(kě)見罕見病研發領域依舊火熱。 下面簡要介紹幾款獲批上市的新(xīn)化藥。 Iqirvo(Elafibranor) 6月10日,益普生宣布美國(guó)FDA已加速批準Iqirvo,Iqirvo是同類首創的口服、每日一次的過氧化物(wù)酶體(tǐ)增殖激活受體(tǐ)(PPAR)激動劑,用(yòng)于治療對UDCA應答(dá)不足的成人原發性膽汁性膽管炎(PBC),或作(zuò)為(wèi)單藥療法治療對UDCA不耐受的患者。這是近十年來首個獲批治療罕見肝病原發性膽汁性膽管炎的新(xīn)藥。 PBC是因為(wèi)膽管的慢性損傷,導緻清除毒素的能(néng)力下降,引發肝硬化和肝功能(néng)衰竭。根據關鍵性3期試驗ELATIVE結果顯示隻有(yǒu)接受elafibranor治療的患者在第52周堿性磷酸酶(ALP)達到正常值,與對照組相比降低幅度達到41%。目前治療罕見自身免疫性PBC患者、治療PBC的炎症、膽汁淤積和纖維化等研究正在進行。值得一提,同靶點藥物(wù)Seladelpar,已獲得FDA優先審評資格,預計8月份公(gōng)布審評結果。 Rytelo(Imetelstat) 6月6日,Geron Corporation的Rytelo被FDA獲批上市,用(yòng)于治療低危骨髓增生異常綜合征(LR-MDS)患者的輸血性依賴性貧血。MDS指阻礙血液(造血)幹細胞成熟為(wèi)健康血細胞的一組癌症,是一種罕見的血癌。如果患者體(tǐ)内沒有(yǒu)足夠的健康血細胞,可(kě)能(néng)會出現貧血、頻繁感染和失控出血等嚴重疾病。 Rytelo是一款first in class端粒酶抑制劑,Imetelstat通過結合并抑制端粒酶,從而調控惡性造血幹細胞的凋亡。1990年Geron成立,從開始研發端粒酶抑制劑到Rytelo上市,Geron花(huā)了30多(duō)年,在經曆一系列的失敗之後,Imetelstat終于在MDS上有(yǒu)了用(yòng)武之地;3期IMerge研究顯示Imetelstat治療後無需輸血的比例顯著高于安(ān)慰劑組。 Xolremdi(Mavorixafor) 4月26日,X4 Pharmaceuticals公(gōng)司宣布美國(guó)FDA批準Xolremdi(mavorixafor)膠囊上市,用(yòng)于治療12歲及以上患有(yǒu)WHIM綜合征的患者,以增加血液循環中(zhōng)成熟中(zhōng)性粒細胞和淋巴細胞的數量。這是首款獲批針對WHIM綜合征患者的小(xiǎo)分(fēn)子療法。WHIM綜合征是一種罕見的原發性免疫缺陷和慢性中(zhōng)性粒細胞減少症,由CXC趨化因子受體(tǐ)4(CXCR4)信号通路障礙引起。 Xolremdi是一種選擇性CXCR4拮抗劑,關鍵3期臨床4WHIM研究結果顯示,與安(ān)慰劑相比,Xolremdi治療顯著增加了中(zhōng)性粒細胞計數(ANC)水平超過阈值(≥500細胞/微升)和絕對淋巴細胞計數(ALC)水平超過阈值(≥1000細胞/微升)的持續時間,安(ān)全性良好。此前,Xolremdi已經被FDA授予突破性療法認定。 Ojemda(Tovorafenib) 4月23日,FDA加速批準Day One Biopharmaceuticals開發的泛RAF激酶抑制劑Ojemda(tovorafenib)上市,用(yòng)于治療6個月及以上的複發或難治性兒童低級别膠質(zhì)瘤(pLGG)患者,這些患者存在BRAF融合或重排,或BRAF V600突變。Ojemda是用(yòng)于治療該疾病的全身療法,它能(néng)夠抑制攜帶BRAF融合或BRAF V600突變的腫瘤的生長(cháng),并且具(jù)有(yǒu)大腦滲透性。先前被FDA授予突破性療法和罕見兒科(kē)疾病資格,這也是基于FIREFLY-1臨床2期試驗數據獲批的原因之一。 兒科(kē)低級别膠質(zhì)瘤是兒童中(zhōng)最常見的腦瘤,在美國(guó),兒童LGG年發病率為(wèi)每十萬人1.3~2.1例,預計每年有(yǒu)1000-1600例新(xīn)發病例。2023年3月16日,FDA批準了諾華的BRAF/MEK組合即Tafinlar(dabrafenib,達拉非尼)聯合Mekinist(trametinib,曲美替尼),這是pLGG的首個靶向療法。 Rezdiffra(Resmetirom) 3月14日,MASH治療領域迎來重大進展,FDA批準Madrigal的口服小(xiǎo)分(fēn)子藥物(wù)Rezdiffra用(yòng)于治療伴有(yǒu)中(zhōng)度至晚期肝瘢痕形成(纖維化)的代謝(xiè)功能(néng)障礙相關脂肪性肝炎成人患者,配合飲食、運動一起使用(yòng)。這是40年來首款獲批上市的MASH藥物(wù)。 Resmetirom是一款甲狀腺激素受體(tǐ)(THR)-β口服選擇性激動劑。THR-β在人體(tǐ)肝髒中(zhōng)高表達,能(néng)夠調節脂代謝(xiè),降低LDL-C、甘油三酯和緻動脈粥樣硬化性脂蛋白,THR-β還可(kě)以通過促進脂肪酸的分(fēn)解和刺激線(xiàn)粒體(tǐ)的生物(wù)發生來減少脂肪毒性并改善肝功能(néng),進而減少肝髒脂肪。
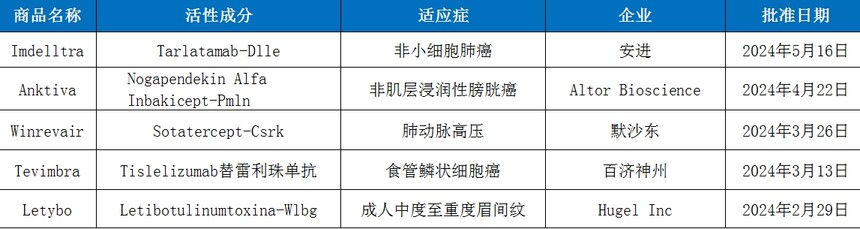
數據來源:FDA、藥智數據 截至目前,2024年上半年CDER共批準了5款生物(wù)藥新(xīn)藥,1款雙抗(Imdelltra),1款細胞因子藥物(wù)(Anktiva),1款融合蛋白(Winrevair),1款單克隆抗體(tǐ)(Tevimbra),1款神經毒素(Letybo)。 從治療領域來看,在獲批的5款生物(wù)藥新(xīn)藥中(zhōng),占比最多(duō)是癌症治療領域,有(yǒu)Imdelltra、Anktiva、Tevimbra 3款新(xīn)藥上市,值得注意的是國(guó)産(chǎn)創新(xīn)藥企百濟神州的Tevimbra(替雷利珠單抗)成功登陸美國(guó)市場成為(wèi)第二款在美上市的PD-1藥物(wù);代謝(xiè)領域有(yǒu)一款Winrevair,另外還有(yǒu)一款醫(yī)美藥物(wù)Letybo上市。 Anktiva 4月22日,ImmunityBio公(gōng)司宣布FDA已經批準Anktiva聯合卡介苗(BCG),用(yòng)于治療卡介苗不響應的非肌層浸潤性膀胱癌(NMIBC)伴原位癌(CIS),伴或不伴乳頭狀瘤患者,成為(wèi)全球首個獲批的白細胞介素-15(IL-15)藥物(wù),這是美國(guó)FDA時隔32年後批準的又(yòu)一款應用(yòng)于腫瘤免疫治療的細胞因子藥物(wù),也是曆史上的第三款。 Anktiva是一種IL-15超激動劑複合物(wù),由IL-15突變體(tǐ)與IL-15Rαsushi結構域以及IgG1 Fc融合蛋白結合而成,IL-15Rαsushi結構域使其無需像天然IL-15通過反式呈遞就可(kě)以激活下遊信号通路,且IgG1-Fc片段極大延長(cháng)了藥物(wù)半衰期。 Winrevair 3月26日,FDA批準了默沙東Winrevair治療肺動脈高壓(PAH)的上市申請,PAH是由于促進和抑制增生信号的不平衡導緻肺動脈壁的血管增厚,限制血流,使得心髒右側負擔日漸加重,最終導緻心力衰竭。 Winrevair是首個獲批的PAH的激活素信号抑制劑療法,該藥物(wù)全年費用(yòng)高達24.2萬美元,據有(yǒu)關機構估計年銷售峰值可(kě)達75億美元。
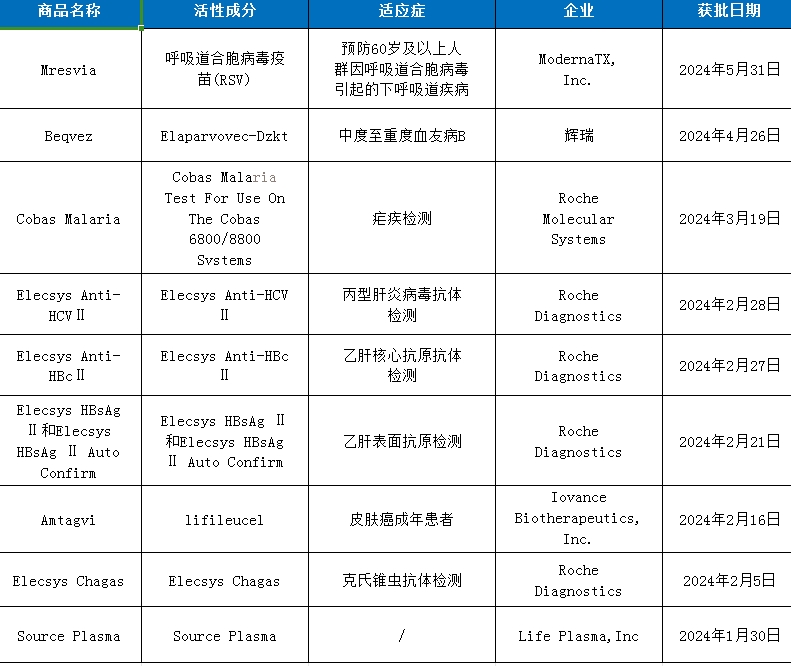
數據來源:FDA、藥智數據 截至目前,CBER批準了9款生物(wù)制品,其中(zhōng)包括一款RSV疫苗(Mresvia),一款基因療法(Beqvez),一款細胞療法(Amtagvi),還有(yǒu)多(duō)款疾病診斷技(jì )術和血液制品。 Beqvez(Elaparvovec-Dzkt) 4月26日,輝瑞宣布FDA已批準Beqvez上市,Beqvez是一種基于腺相關病毒(AAV)載體(tǐ)的基因療法,用(yòng)于治療中(zhōng)度至重度血友病B且對AAV血清型Rh74的中(zhōng)和抗體(tǐ)檢測為(wèi)陰性的成年(18歲及以上)患者。據悉Beqvez定價為(wèi)350萬美元,能(néng)通過一次性治療産(chǎn)生自體(tǐ)的凝血因子IX蛋白,目前的标準治療則需要定期輸注凝血因子IX。 Amtagvi(Lifileucel) 2月16日,Iovance Biotherapeutics宣布,FDA已通過加速批準Amtagvi上市,lifileucel是一種腫瘤浸潤淋巴細胞(TIL)治療方案,用(yòng)于治療PD-1/PD-L1治療後進展的晚期黑色素瘤。 Lifileucel是全球首款獲批上市的TIL細胞療法,該療法從腫瘤細胞中(zhōng)分(fēn)離浸潤的淋巴細胞,在體(tǐ)外擴增後像CAR-T療法樣回輸給患者,可(kě)以特異性識别患者的腫瘤細胞進行殺傷。根據C-144-01研究已讀出的結果顯示,隊列4的73名(míng)患者中(zhōng)31.5%的患者達到客觀緩解。 結語 今年上半年,美國(guó)FDA批準的新(xīn)藥中(zhōng)抗腫瘤、自免、代謝(xiè)、抗感染和罕見病仍是熱點領域,與去年相比腫瘤藥物(wù)占比明顯提高,這表明腫瘤藥物(wù)仍是藥物(wù)研發的熱點。在獲批的化藥新(xīn)藥中(zhōng)罕見病藥物(wù)占比接近一半,在FDA的政策鼓勵下,可(kě)見藥企對罕見病治療藥物(wù)的研發熱情依然高漲,另外MASH治療領域的突破和多(duō)款FIC藥物(wù)獲批同樣令人欣喜。突破還在繼續,2024下半年同樣不平凡。6月11日,禮來公(gōng)司的阿爾茨海默病藥物(wù)donanemab,被藥物(wù)咨詢委員會以11:0的票數一緻贊同該藥物(wù)的有(yǒu)效性,預計不久也将獲批上市。 除此之外,FDA又(yòu)會批準哪些藥物(wù)呢(ne),我們拭目以待! 參考資料: 1.藥智數據、FDA 2.各企業官網 3.近十年首款!Ipsen又(yòu)一罕見肝病新(xīn)藥獲FDA加速批準。(藥明康德(dé)) 4.40年來首款非酒精(jīng)性脂肪性肝炎創新(xīn)藥獲FDA批準上市(澎湃新(xīn)聞) 5.全球首個IL-15藥物(wù)獲批!ImmunityBio的Anktiva獲FDA批準用(yòng)于治療卡介苗不響應的非肌肉浸潤性膀胱癌(凱萊英新(xīn)聞) 轉載鏈接:2024上半年FDA批準的新(xīn)藥_騰訊新(xīn)聞 (qq.com) 如有(yǒu)侵權請聯系我們,我們将會删除。 優南推薦産(chǎn)品
|